"임상시험 엔드포인트(clinical trial endpoint)는 진공 상태로 존재하는 것이 아니다. 잘 설계된 임상시험의 엔드포인트의 경우 임상현장과 환자에게 의미있는 혜택과 정의를 포함해야 한다. 결국 이러한 내용이 실제 제품화 단계에서 약물 라벨에 반영될 수 있다."
니콜라스 케니(Nicholas Kenny)시네오스헬스(Syneos Health) 최고의학책임자(CMO)는 10일 열린 'NDA와 BLA를 위한 임상 엔드포인트를 선택하는 방법(How to Select Clinical Endpoint for NDA/BLA)'을 주제로 한 세션에서 이같이 말했다. 이날 세션에는 문한림 커넥트클리니컬사이언스 대표, 패트릭 해링턴(Patrick Harrington) 시네오스헬스 박사, 샘 림(Sam Lim) 존슨앤존스 R&D 총책임자가 발표를 맡았다.

희귀질환은 임상의, 환자, 보험기관 등 유기적 관계 고려해야
미국과 유럽의 다른 규제 꼼꼼히 살펴봐야
희귀질환은 현재까지 알려진 것만 약 7000여개다. 아직까지 규명되지 못한 질환도 매우 많으며, 제대로 된 임상적 유용성과 임상시험 지표조차 확립되지 못한 질환 군이 많다. 때문에 환자, 임상의와 유기적인 관계를 통해 새로운 지표 마련이 필요하다는 조언이 나왔다.
니콜라스 CMO는 "희귀질환의 경우 환자, 임상의, 보험기관 등 여러 이해당사자의 입장을 종합적으로 고려해야한다"며 "이러한 모든 이해당사자들의 해당 약물의 이점(benefit)을 인식하고, 임상 데이터를 통해 증명한다면 허가까지 순조롭게 진행될 수 있을 것"이라고 말했다.
그러면서 그는 "희귀질환의 경우 아직 병의 원인을 비롯한 히스토리를 파악하지 못한 경우가 다수 있다"며 "때문에 희귀질환은 환자, 의사, 규제당국과 협업해 새로운 임상 엔드포인트를 개발할 필요가 있다"고 설명했다. 이어 "새롭게 개발된 엔드포인트가 유의미하게 받아들여지려면 환자, 임상의, 보험당국 모두가 납득할 수 있어야 할 것"이라고 덧붙였다.
특히 상용화의 가장 근접한 임상 3상시험을 수행할 때는 규제당국과 소통을 활발히 진행해야 한다고 강조했다.
그는 "3상 임상을 진행할 때, 규제당국과 활발하게 대화와 협의를 해야지만 추후 허가신청(NDA)을 할 때, 규제당국이 무리없이 임상시험 디자인과 엔드포인트를 수용할 수 있다"며 "규제당국 별 가이던스에 따라 질환별 카테고리를 유심히 살펴봐야 할 것"이라고 조언했다.
또 최근 활발하게 개발이 이뤄지고 있는 비알코올성지방간염(NASH) 치료제 개발을 위한 임상을 진행 할 때, 미국과 유럽이 임상지표를 인정하는 기준이 다른 사례도 소개했다.
그는 "NASH 치료제 개발 임상시험의 경우 미국 식품의약국(FDA)와 유럽의약품청(EMA)이 인정하는 임상시험 엔드포인트의 차이가 있다"며 "FDA는 ▷지방간소실 ▷섬유화개선 중 하나를 충족해야 하지만, EMA의 경우 두 지표 모두를 충족해야 한다"고 설명했다.
이어 "NASH 치료제 개발을 위한 임상시험이 워낙 활발히 이뤄지고 있다보니, 임상지표를 어떻게 볼지는 현재까지도 열띤 논의가 이어지고 있다"며 "FDA와 EMA가 인정하는 임상지표가 다르다는 것을 인지하고, 향후 이런 데이터 수집을 어떻게 할지 미리 계획을 세워야 한다"고 강조했다.
항암제 개발 임상, OS 외에도 ORR, DFS 등 다양한 지표 고려해야
항암제 개발을 위한 임상은 전체생존기간(OS)이 무엇보다 중요한 지표이지만, 이 외 객관적반응률(ORR)과 무명생존율(DFS)에 대한 고려도 필요하다.
문한림 커넥트클리니컬 사이언스 대표는 "항암제 개발 임상에서 OS가 가장 중요한 임상적 지표지만, 그 외에도 다양한 증상 개선을 입증할 수 있는 지표를 활용하는 방안도 적극 고려해야 한다"며 "효능 뿐만 아니라 반응률(reponse rate)과 지연 반응(duration rate)에 대한 고려도 필요하다"고 강조했다.
구체적으로 ▷암젠의 엑스지바(데노수맙) ▷화이자의 잴코리(크리조티닙) ▷애브비의 벤클락스타(베네토클락스)가 소개됐다.
문 대표는 "데노수맙의 경우 골격계합병증(SRE)을 임상지표로 삼아 새로운 임상적 혜택을 입증했고, 잴코리는 ORR의 데이터가 매우 높게 나와 이 데이터로 허가를 받고, 비소세포폐암에서 신속허가를 추진하게 됐다"고 말했다. 이어 "벤클락스타는 완전관해(CR)를 엔드포인트로 잡아 급성백혈병(AML)에 임상적 유용성을 입증했다"고 설명했다.
알츠하이머 임상, 진단부터 치료까지 다양한 요소 고려해야
알츠하이머 임상시험 엔드포인트는 ▷인지테스트(cognitive tests) ▷임상의평가(clinicial assessed) ▷환자와 보호자 보고(patient/caregiver report) ▷실험실과 이미지(lab and imaging)의 모든 요건이 충족돼야 한다.
알츠하이머 진단을 위한 인지테스트로 가장 널리 사용되는 것은 알츠하이머병 평가척도(ADAS-cog)와 간이정신상태검사(MMSE)다. 임상의가 가장 널리 쓰는 평가 지표로는 CDR-Sum of Boxes가 있다.
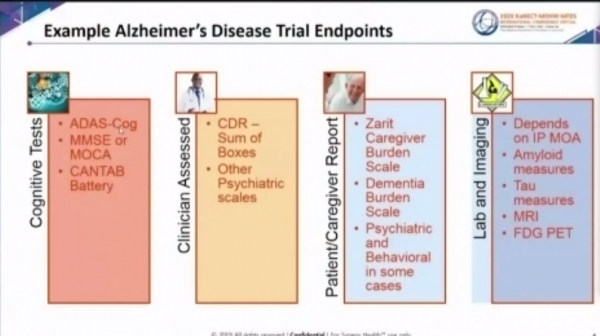
패트릭 해링턴(Patrick Harrington) 시네오스헬스 박사는 "알츠하이머의 진행 상황에 따라 CDR-Sum of Boxes의 내용이 매우 다양하다"며 "때문에 환자와 보호자가 해당 질환에 대한 증상을 보고하는 것은 매우 중요하며, 알츠하이머의 경우 보호자의 부담이 가중되기 때문에, 임상 현장에서 보호자의 부담이 얼마나 가중되는지 평가하기도 한다"고 말했다.
그러면서 "알츠하이머는 개발하는 약물들이 아밀로이드 단백질, 타우 단백질 등 기전이 매우 다양하기 때문에 관련 물질을 측정을 초기에 미리 수행해야 한다"고 조언했다.
파킨슨병 치료제 개발을 위해서는 디지털 바이오마커를 적극 활용해야 한다는 의견도 나왔다.
패트릭 박사는 "최근 디지털 바이오마커로 파킨슨병 환자의 얼굴 표정이나 음성의 떨림 등을 스마트폰을 활용해 손쉽게 측정할 수 있는 도구가 나왔다"며 "수초 내에 해당 증상에 대한 데이터 수집이 가능하다"고 말했다. 이어 "(웨어러블 기기 등을 통해)수집된 자료를 정량화하고, 치료 반응에 대한 평가지표로 충분히 활용할 수 있을 것"이라고 덧붙였다.
